广东省卫生健康委办公室转发国家卫生健康委办公厅关于部分消毒剂在新型冠状病毒感染的肺炎防控期间紧急上市的通知
粤卫办监督函〔2020〕6号
各地级以上市卫生健康局(委),省卫生监督所、省卫生健康委政务服务中心:
现将《国家卫生健康委办公厅关于部分消毒剂在新型冠状病毒感染的肺炎防控期间紧急上市的通知》(国卫办监督函〔2020〕99号)转发给你们,并提出以下要求,请一并组织实施。
一、紧急上市消毒剂包括乙醇类、含氯消毒剂(次氯酸钠、次氯酸钙、二氯异氰尿酸钠、三氯异氰尿酸)、二氧化氯消毒剂、过氧乙酸消毒剂。
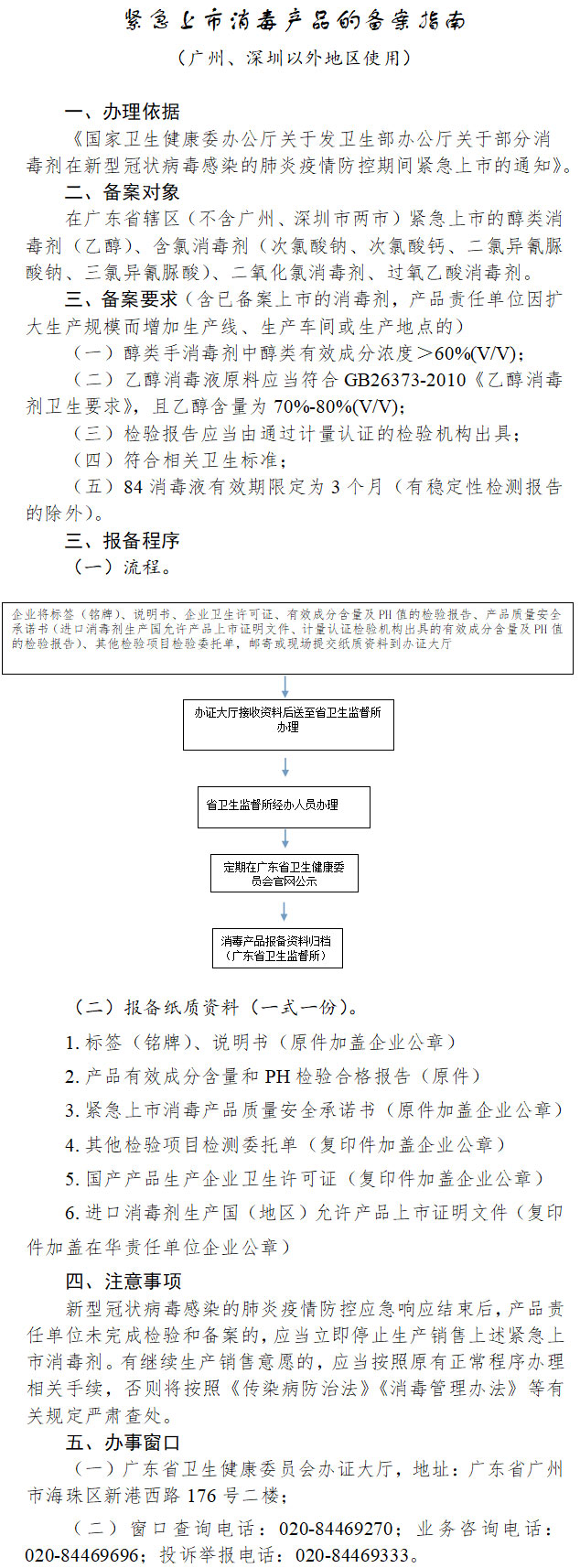
二、产品责任单位检测(或委托检测)的检测报告应由通过计量认证的检验机构出具。与已备案产品同类的进口消毒剂的检验项目要求与国产产品相同。
三、紧急上市消毒剂的国内生产企业应当取得消毒产品生产企业卫生许可证,并在有效期限内;且符合相应的生产项目、生产类别、生产目录和生产工艺要求。
四、紧急上市消毒剂的国内生产企业在产品上市销售前,应当按要求向消毒产品备案部门提交书面材料,同时提供按照《消毒产品卫生安全评价技术要求》(WS628-2018)要求进行其余检测项目的检验委托单(具体材料清单详见附件3)。
五、负责紧急上市消毒产品报备部门与原消毒产品备案部门一致。广州、深圳市辖区内紧急上市消毒产品报备工作分别由广州、深圳市卫生健康部门负责办理,其余的按紧急上市消毒产品的备案指南(附件3)办理。广州、深圳应结合本地实际尽快制定备案指南,并向社会公布。
六、各地级以上市卫生健康部门应根据本地实际优化消毒产品生产企业卫生许可证办理流程,加快办理,积极通过多种途径提供有关申请工作的咨询服务和指导,方便企业办事。
七、新型冠状病毒感染的肺炎疫情防控应急响应期间,各地要加强对消毒产品生产企业的事中事后监督,同时强化对流通市场和使用单位(医疗机构)消毒产品的监督,必要时进行抽样检测,对不合格产品要严肃查处,确保消毒产品的卫生质量。
附件:1.国家卫生健康委办公厅关于部分消毒剂在新型冠状病毒感染的肺炎疫情防控期间紧急上市的通知
2.紧急上市消毒产品质量安全承诺书(参考格式)
3.紧急上市消毒产品的备案指南(广州、深圳以外地区使用)
广东省卫生健康委办公室
2020年2月6日
附件1
国家卫生健康委办公厅关于部分消毒剂
在新型冠状病毒感染的肺炎疫情防控期间
紧急上市的通知
国卫办监督函﹝2020﹞99号
各省、自治区、直辖市及新疆生产建设兵团卫生健康委:
当前新型冠状病毒感染的肺炎疫情形势严峻,部分地区出现消毒剂供应紧张问题。为保障全国消毒剂的有效供给,现就有关事项通知如下:
一、紧急上市的醇类消毒剂在产品责任单位检测(或委托检测)含量合格后可上市销售使用,醇类手消毒剂醇类有效成分浓度>60%(V/V),其他乙醇消毒液原料应当符合GB26373-2010《乙醇消毒剂卫生要求》且乙醇含量为70%-80%(V/V)。
二、紧急上市的含氯消毒剂、二氧化氯消毒剂、过氧乙酸消毒剂,在产品责任单位检测(或委托检测)有效成分含量和pH符合相关卫生标准后,可上市销售使用。84消毒液有效期限定为3个月(有稳定性检测报告的除外)。
三、已备案上市的消毒剂,产品责任单位因扩大其生产规模而增加生产线、生产车间或生产地点的,在产品责任单位检测(或委托检测)消毒剂有效成分含量和pH符合相关卫生标准后,可上市销售使用。
上述紧急上市消毒剂的国内生产企业应当取得消毒产品生产企业卫生许可证。在产品上市销售前,应当及时向属地消毒产品备案部门提交消毒剂标签说明书和产品质量安全承诺书(附消毒剂有效成分含量和pH检测合格报告)。与已备案产品同类的进口消毒剂,在华责任单位向属地消毒产品备案部门提交产品质量安全承诺书(附国外产品上市证明文件和检验报告)后,可先行上市销售使用。
上述紧急上市消毒剂在上市销售使用的同时,产品责任单位应当按照WS628-2018《消毒产品卫生安全评价技术要求》的检验项目进行检测,并按规定进行备案。新型冠状病毒感染的肺炎疫情防控应急响应结束后,产品责任单位未完成检验和备案的,应当立即停止生产销售上述紧急上市消毒剂。有继续生产销售意愿的,应当按照原有正常程序办理相关手续,否则将按照《传染病防治法》、《消毒管理办法》等有关规定严肃查处。
国家卫生健康委办公厅
2020年2月3日
附件2

附件3